|
ОСОБЕННОСТИ НАКОПЛЕНИЯ ФЕНОЛЬНЫХ СОЕДИНЕНИЙ В СУСПЕНЗИОННЫХ КУЛЬТУРАХ И РАСТЕНИЯХ-РЕГЕНЕРАНТАХ МОРКОВИ ПРИ ДЕЙСТВИИ ЭКЗОМЕТАБОЛИТОВ ГРИБА ALTERNARIA RADICINA Калашникова Е.А.1, Гончарук Е.А.2, Загоскина Н.В.2
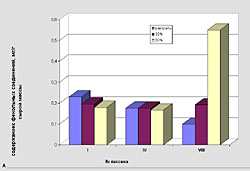
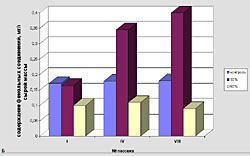
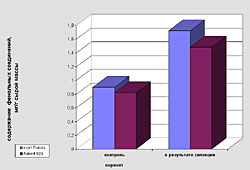
Высшие растения образуют различные вторичные метаболиты, в том числе и фенольной природы [1]. Функции этих веществ связаны с процессами фотосинтеза, дыхания, а также устойчивости к различным стрессовым воздействиям, в том числе и к действию патогенов [2, 3]. Для моркови наиболее распространенным и опасным фитопатогеном является Alternaria radicina (черная гниль), вызывающая мацерацию тканей [4]. При этом происходит побурение нижней части стебля, листовой пластинки, соцветия и семян в процессе онтогенеза растений, а также корнеплодов (при их хранении). В связи с этим одним из важных направлений современной селекции является создание устойчивых форм, сортов и гибридов моркови. Успешное решение данной проблемы может осуществляться не только традиционными методами селекции, но и с использованием биотехнологических подходов, позволяющих повысить эффективность работы в данном направлении. Ведущее место в этом случае занимает клеточная селекция, позволяющая в условиях in vitro проводить отбор клеточных популяций, устойчивых к селективному фактору (например, фитопатогену или его экзометаболитам), а затем и регенерировать целые растения с повышенной устойчивостью [5]. Однако нельзя забывать и тот факт, что в условиях действия биотических факторов, в том числе патогенов, происходят изменения морфофизиологических характеристик растений, подавляется их рост и снижается продуктивность [6]. Изменяются и метаболические процессы, в том числе и биосинтез фенольных соединений, которые, как известно, участвуют в защите клеток как от проникновения патогенов, так и действия их метаболитов [3,7, 8]. Учитывая важную роль фенольных соединений в защитных реакциях, целью нашего исследования являлось изучение изменений в их накоплении и составе на примере клеток суспензионных культур моркови, культивируемых в стандартных условиях или в присутствии экзометаболитов патогена Alternaria radicina (стрессовые условия), а также в полученных из них растениях-регенерантах. ОБЪЕКТ И МЕТОДЫ ИССЛЕДОВАНИЯ. Объектом исследования служили два генотипа моркови, обладающие различной полевой устойчивостью к грибу Alternaria radicina. Линия 906 относилась к среднеустойчивой группе, выведенной в Институте селекционных исследований Германии из сортотипа Нантская. Генотип Rondo являлся неустойчивым сортом, полученным в Германии. Семена этих культур были любезно предоставлены сотрудниками лаборатории селекции и семеноводства овощных культур ВНИИовощеводства (Московская обл., Россия). Клеточную селекцию проводили на суспензионной культуре полученной из хорошо пролиферирующей каллусной ткани, выращенной на питательной среде Мурасига и Скуга, содержащей 2,4-Д 1,5 мг/л, сахарозу 2% и агар 0,8% [9]. Суспензию клеток выращивали в колбах (в 20 мл питательной среды) на аппарате роллерного типа со скоростью вращения 100 об/мин. Пересадку культуры проводили через 14 суток. В качестве селективного фактора использовали культуральный фильтрат A. radicina, содержащий экзометаболиты гриба, который добавляли в питательную среду в концентрациях 30% или 50% от конечного объема питательной среды. После селекции, суспензионную культуру платировали на агаризованную питательную среду, получали микрокаллус, из которого в дальнейшем получали растения-регенеранты. Для извлечения фенольных соединений использовали свежий растительный материал (клеточную массу суспензий и ткани растений-регенерантов и) экстрагировали 96%-ным этанолом. В полученных экстрактах спектрофотометрическим методом определяли содержание фенольных соединений с использованием реактива Фолина-Дениса [10]. Калибровочную кривую строили по рутину. Состав фенольных соединений анализировали методом тонкослойной хроматографии на микрокрасталлической целлюлозе [11]. В качестве растворителя использовали систему н-бутанол+уксусная кислота+вода (40:12:28, по объему). Идентификацию веществ проводили на основании их флюоресценции в ультрафиолетовом свете, а также по качественной реакции с 1%-ным водным раствором хлорного железа и красной кровяной соли РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ. Известно, что устойчивость растений к патогенам часто коррелирует с содержанием в них фенольных соединений [3, 7]. В связи с этим первоочередной нашей задачей являлось сравнение изменений в накоплении этих вторичных метаболитов при длительном культивировании клеточных суспензий как в контрольных, так и стрессовых условиях, а именно в присутствии 30%:-ного или 50%-ного культурального фильтрата патогена (рис. 1). Как следует из полученных данных при культивировании суспензионной культуры моркови в стандартных и стрессовых условиях (присутствие в питательной среде экзометаболитов гриба Alternaria radicina в различных концентрациях) приводит к изменению суммарного содержания растворимых фенольных соединений, которое зависит как от исследуемого генотипа, так и от условий культивирования. Например, присутствие культурального фильтрата патогена в питательной среде в различных концентрациях приводило к уменьшению синтеза фенольных соединений в среднем на 10-12% по сравнению с контролем во время I-го пассажа (Рис. 1). Причем для линии 906 воздействие селективного фактора (50% КФ) существенно повлияло на снижение их количественного содержания (на 42%). В процессе культивирования суспензионной культуры двух изучаемых генотипов на селективных средах, способность клеток к синтезу фенольных соединений изменялась. В одних вариантах она постоянно увеличивалась (для сорта Rondo при 50% -ном КФ, для линии 906 при 30% -ном КФ), тогда как в других случаях – была относительно стабильна (для сорта Rondo при 30%-ном КФ, для линии 906 при 50%-ном КФ). Все это свидетельствует об отличиях в чувствительности клеток суспензии к действию стрессового фактора, что, возможно, проявляется и в различных механизмах их устойчивости к экзометаболитам патогена. Далее мы остановил свое внимание на растениях-регенерантах моркови. Как следует из представленных на рис. 2 данных, у контрольных вариантов содержание фенольных соединений было в 1,5 - 2 раза ниже, чем у растений, полученных в результате клеточной селекции в присутствии экзометаболитов гриба A. radicina. Следует также отметить, что во всех условиях растения-регенеранты моркови сорта Rondo характеризовались более высоким уровнем накопления фенольных соединений, по сравнению с линией 906 (сортотип Нантская). Изучение состава фенольных соединений показало, что у растений-регенерантов, полученных после селекции in vitro, он более разнообразен, чем в контроле (данные не приводятся) Вероятно, это связано с изменениями в их метаболизме, что и проявляется в более разнообразном составе синтезируемых веществ. Все вышеизложенное позволяет заключить, что присутствие экзометаболитов гриба Alternaria radicina при клеточной селекции моркови приводит к изменениям в их фенольном метаболизме. Это проявляется как на уровне накопления этих веществ вторичного метаболизма, так и на их качественном составе. ЛИТЕРАТУРА
| Внимание! Эта статья опубликована, на нее можно ссылаться при написании научных работ. Ссылка на эту публикацию выглядит так: Калашникова Е.А., Гончарук Е.А., Загоскина Н.В. Особенности накопления фенольных соединений в суспензионных культурах и растениях-регенерантах моркови при действии экзометаболитов гриба Alternaria radicina // Фенольные соединения: фундаментальные и прикладные аспекты: материалы докладов VIII Международного симпозиума. Москва, 2-5 октября 2012 г. /отв. ред. Н.В. Загоскина – М.: ИФР РАН; РУДН, 2012. С. 295-300. (ISBN 978-5-209-04571-7). Иллюстрации к этой статье: Рис. 1. Изменения в содержании растворимых фенольных соединений в суспензионных культурах моркови, культивируемых в стандартных (контроль) и стрессовых (присутствие экзометаболитов A. radicina – 30% и 50% культурального фильтрата) условиях. А - сорт Rondo, Б - линия 906 (сортотип Нантская) Рис. 2. Суммарное содержание растворимых фенольных соединений в растениях-регенерантах, полученных в контрольных (контроль) и селективных условиях (в присутствии экзометаболитов A. radicina, 50%) |
(с) Авторские права: перепечатка и копирование материалов разрешена без ограничений с простановкой ссылок на авторов и издание, где опубликован материал.
Copyrights: Non commercial using of these materials is permitted with obligatory informing of the authors and linking to the source.