|
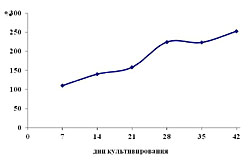
ИЗМЕНЕНИЕ УРОВНЯ ПОЛ, ОБРАЗОВАНИЯ ФЕНОЛЬНЫХ СОЕДИНЕНИЙ И АКТИВНОСТИ ПЕРОКСИДАЗЫ ПО МЕРЕ РОСТА КАЛЛУСНОЙ КУЛЬТУРЫ СТЕБЛЯ ЧАЙНОГО РАСТЕНИЯ Зубова М.В.1, Нечаева Т.Л.2, Гончарук Е.А.2, Клейменова Ю.3, Живухина Е.А.1, Назаренко Л.В.31Московский государственный педагогический университет, Москва 2ФГБУН Институт физиологии растений им. К.А.Тимирязева РАН, Москва 3Московский городской педагогический университет Фенольные соединения являются одними из наиболее распространенных вторичных метаболитов, образование которых свойственно практически всем растительным клеткам [1]. Они принимают участие в самых разнообразных физиологических процессах, таких как фотосинтез, дыхание, формирование клеточных стенок, защите растений от различных патогенов и стрессовых факторов [2]. При проведении фундаментальных исследований по физиологии, генетике, молекулярной биологии и цитологии растений успешно используются клеточные культуры растений [3]. Характерной их особенностью является сохранение многих свойств интактных клеток. Это относится и к синтезу полифенолов, образование которых происходит в культурах in vitro. Именно в этой системе были изучены многие аспекты метаболизма этих веществ и его регуляции [4]. Одним из наиболее удобных объектов для исследования биосинтеза полифенолов являются ткани и клетки чайного растения, в том числе и культивируемые в условиях in vitro [5]. Это связано с тем, что для них характерна высокая способность к накоплению разнообразных соединений фенольной природы. Известно, что в процессе жизнедеятельности растений всегда образуются активные формы кислорода, которые в стрессовых условиях приводят к развитию окислительного стресса – достаточно пагубного для них [6]. Важным показателем является уровень перекисного окисления липидов (ПОЛ), свидетельствующий об изменениях в мембранах клеток и их ответа на окислительный стресс. Считается, что причиной окислительного стресса является не столько продукция АФК, сколько нарушение баланса между их генерацией и удалением [7]. Последнее осуществляется системой антиоксидантной (или противоокислительной) защиты, включающей многочисленные антиоксиданты, классификация которых чрезвычайно разнообразна [8]. Наиболее часто их подразделяют на высокомолекулярные и низкомолекулярные компоненты [9]. К первым относятся различные ферменты, в том числе супероксиддисмутаза (СОД), каталаза, пероксидазы и др., характеризующиеся высокой специфичностью действия по отношению к определенным формам АФК. Ко вторым - низкомолекулярные вещества, такие как аскорбиновая кислота, глутатион, каротиноиды, фенольные соединения и др., которые взаимодействуют с АФК и «нейтрализуют» их. Все эти компоненты антиоксидантной системы находятся в постоянном взаимодействии и поддержание их баланса важно для сохранения жизнеспособности растений. Следует также подчеркнуть, что изменения в антиоксидантной системе растительных клеток зависят от продолжительности и типа стрессового воздействия, а также от устойчивости самого растительного организма [6, 9]. Целью нашего исследования являлось изучение изменений в уровне ПОЛ, содержании низко- и высоко-молекулярных антиоксидантов (на примере, соответственно, фенольных соединений и пероксидазы) в процессе цикла культивирования каллусной культуры чайного растения. ОБЪЕКТ И МЕТОДЫ ИССЛЕДОВАНИЯ Объектом исследования являлась гетеротрофная каллусная культура стебля чайного растения (Camellia sinensis L.), выращивая в условиях факторостата в темноте на на модифицированной питательной среде Хеллера, содержащей 2,4-Д (5 мг/л) и глюкозу (20 г/л) [10]. Длительность пассажа составляла 45 дней. При проведении исследования каллусные культуры анализировали через каждые 7 дней и определяли их морфо-физиологические характеристики, прирост каллусной массы и ее оводненность (высушивание при 70оС) [11]. Фенольные соединения извлекали из свежей каллусной ткани 96%-ным этанолом. В экстрактах спектрофотометрическим методом определяли содержание суммы растворимых фенольных соединений (с реактивом Фолина–Дениса; поглощение при 725 нм) [12]. Калибровочную кривую строили по (-)-эпикатехину. Для определение активности гваякол-зависимых пероксидаз каллусную ткань растирали в холодном 0,066 М K/Na фосфатном буфере (рН 7,4), содержащем поликлар АТ (1% от навески). Гомогенат центрифугировали (20 мин, 13000 об/мин) и надосадочную жидкость использовали для определения активности пероксидазы ранее описанным методом на основании ее реакции с гваяколом (спектрофотометрирование при 460 нм) [13]. Содержание белка определяли по методу Брэдфорд [14]. Определение перекисного окисления липидов (ПОЛ) проводили по накоплению малонового диальдегида (МДА), определяемого по цветной реакции с тиобарбитуровой кислотой при длине волны 532 нм [15]. Статистическая обработка. Все определения проводили в трех биологических и 2-3 аналитических повторностях. Результаты обрабатывали статистически. На диаграммах представлены средние арифметические значения определений и их квадратичные отклонения. РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ Гетеротрофная каллусная культура стебля чайного растения представляла собой медленно растущий плотный каллус светло-бежевого цвета. К концу пассажа она приобретала более темный цвет, что, вероятно, является следствие ее старения. Для каллусной культуры чайного растения характерна достаточно низкая скорость роста, которая носит почти линейный характер (рис. 1 А). Важным аспектом при оценке роста каллусных культур является определение их оводненности. Как следует из полученных данных в культуре чайного растения она была достаточно высокой и составляла 92-94% (рис. 1 Б). Более высокий ее уровень характерен для завершающих фаз роста, что свидетельствует об усилении процесса растяжения клеток и их вакуолизации [25]. Таблица
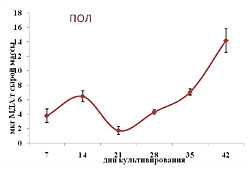
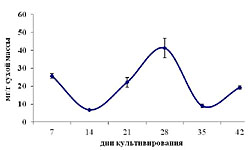
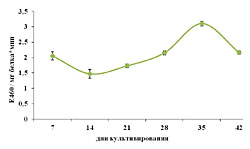
Как уже отмечалось выше, в клетках растений всегда присутствуют активные формы кислорода, что естественно отражается на протекающих в них метаболических процессах, в том числе и структурной организации мембран, о чем косвенно свидетельствует на уровень ПОЛ [26]. Как следует из полученных нами данных, на начальных этапах (7-14 дни) этот показатель возрастал, а потом резко снижался до минимального значения к 21-му дню (рис. 2). В дальнейшем же он практически линейно увеличивался до конца пассажа и превышал исходные значения (7 день роста) почти в 4 раза. Это свидетельствует о значительных изменениях в функционировании антиоксидантной системы и, как следствие, изменениях в структуре мембран. В нашем случае мы остановили внимание лишь на таких компонентах антиоксидантной системы, как пероксидаза и фенольные соединения. В то время как уровень ПОЛ к 14 дню культивирования возрастал, а к 21 - снижался, накопления суммы фенольных соединений и активность пероксидазы имели прямо противоположные тенденции: к 14 дню уменьшались до своих минимальных значений, а к 21 – увеличивались (рис. 3). В случае низкомолекулярных антиоксидантов корреляция с уровнем ПОЛ прослеживалась лишь в период с 21 по 28 день культивирования, после чего количество фенольных соединений резко уменьшалось к 35-дню, а к концу цикла незначительно возрастало(рис. 2 и 3 А). Что же касается высокомолекулярных антиоксидантов, в частности пероксидазы, то изменения в ее активности в определенной степени коррелировали с уровнем ПОЛ в период с 21 по 35 день роста. В дальнейшем этой тенденции уже не отмечалось, а именно ее уровень снижался, тогда как уровень ПОЛ продолжал возрастать. Из всего выше изложенного следует, что повышение уровня ПОЛ в каллусной культуре чайного растения в конце пассажа, в определенной степени, может быть следствием снижения уровня эндогенных антиоксидантов, как выско- так и низкомолекулярных форм. И именно этот факт, вероятно и является причиной старения культуры, проявляющейся в потемнении каллусов и формировании некротических участков. ЛИТЕРАТУРА
| Внимание! Эта статья опубликована, на нее можно ссылаться при написании научных работ. Ссылка на эту публикацию выглядит так: Зубова М.В., Нечаева Т.Л., Гончарук Е.А., Клейменова Ю., Живухина Е.А., Назаренко Л.В. Изменение уровня ПОЛ, образования фенольных соединений и активности пероксидазы по мере роста каллусной культуры стебля чайного растения // Фенольные соединения: фундаментальные и прикладные аспекты: материалы докладов VIII Международного симпозиума. Москва, 2-5 октября 2012 г. /отв. ред. Н.В. Загоскина – М.: ИФР РАН; РУДН, 2012. С. 282-288. (ISBN 978-5-209-04571-7). Иллюстрации к этой статье: Рис. 1. Динамика роста каллусной культуры стебля чайного растения Рис. 2. Изменение уровня ПОЛ по мере роста каллусной культуры стебля чайного растения. Рис. 3. Изменения в суммарном содержании фенольных соединений (А) и активности пероксидазы (Б) по мере роста каллусной культуры стебля чайного растения. | ||||||||||||||||||||||||||
(с) Авторские права: перепечатка и копирование материалов разрешена без ограничений с простановкой ссылок на авторов и издание, где опубликован материал.
Copyrights: Non commercial using of these materials is permitted with obligatory informing of the authors and linking to the source.