|
ВЛИЯНИЕ ХИМИЧЕСКИХ МУТАГЕНОВ НА ИЗМЕНЧИВОСТЬ ОКРАСКИ И ОБРАЗОВАНИЕ АНТОЦИАНОВ И ФЛАВОНОЛОВ В ЦВЕТКАХ PETUNIA HYBRIDA HORT. Широкова А.В.1, Николаева Т.Н.2, Ташлицкий В.Н.3, Костяновский Р.Г.4, Кадоркина Г.К.4, Крутиус О.Н.41Институт биологии развития им. Н.К. Кольцова РАН, Москва 2Институт физиологии растений им. К.А. Тимирязева РАН, Москва 3Московский государственный университет, химический факультет, Москва 4Институт химической физики им. Н.Н. Семенова РАН, Москва Эффективным инструментом при изучении процессов развития растений являются химические мутагены, несмотря на то, что между индукцией мутаций и ее визуальным определением лежит длинная цепь регуляторных звеньев [1]. И в этом случае весьма перспективно исследовать изменчивость окраски цветка, как наиболее вариабельного признака. В большинстве семейств высших растений окраску цветка обусловливают антоцианы, флавоны и флавонолы, относящиеся к обширному классу флавоноидов - фенольных соединений C6-C3-C6 ряда [2]. Большинство флавоноидов, описанных в литературе, представляет собой гликозиды, которые хорошо растворимы в воде и находятся в вакуолях клеток [3,4]. Они выполняют разные функции в растениях, суть которых сводится к поддержанию их жизнедеятельности и размножению. В цветках антоцианы, флавоны и флавонолы служат для привлечения опылителей, и таким образом, способствуют опылению и образованию семян [5]. Антоцианидины, являющиеся агликонами антоцианов, представляют собой производные катиона флавилия. Основные из них - это пеларгонидин, цианидин, дельфинидин, пеонидин, петунидин и мальвидин. Все они представлены в цветках покрытосеменных по отдельности или в различных сочетаниях, что и определяет целый спектр их оттенков: от оранжевого, розового, алого и красного до розовато-лилового, фиолетового и голубого [3]. Часто цианидин встречается в сочетании либо с пеларгонидином и/или пеонидином, либо с дельфинидином. Дельфинидину могут сопутствовать и его производные – мальвидин или петунидин. Флавонолы также широко распрорастранены в высших растениях. Они близки по структуре к антоцианидинам и придают цветкам желтую или кремовую окраску [2, 5]. Нельзя забывать и о том, что окраска цветка обусловлена взаимодействием многих мультигенов, часто неаллельных. Гены, контролирующие отдельные ступени синтеза различных классов флавоноидов и их модификации, регуляторные гены, включающие и отключающие его «рукава», влияющие на концентрацию, поддерживающие рН, копигментацию и взаимодействие с ионами металлов уже клонированы во многих видах растений. Широко распространены различные типы модификации флавоноидов: гидроксилирование, метилирование гидроксильных групп, гликозилирование, ацилирование и другие реакции. [6]. Окраска цветка часто зависит от активности ферментов, которые гидроксилируют антоциановые молекулы в различных положениях. Однако, если гены для одного и более энзимов на ранних этапах флавоноидного метаболизма не функционируют, пигменты могут не образоваться. Гибридизация или воздействия мутагенами могут вызвать восстановление активности ферментов, отвечающих за синтез различных флавоноидов, блокированных на разных его этапах у сортов и видов. Целью нашей работы было изучение действия мутагенов на состав флавоноидных пигментов в цветках петунии, чтобы уже в поколении М2 выделить формы наименее варьирующие по этому признаку. МАТЕРИАЛЫ И МЕТОДЫ Обработка семян мутагенами и получение форм с новыми окрасками. Семена петунии (Petunia hybrida Hort ) сорта 'Snow Ball' были обработаны водными растворами мутагенов в следующих концентрациях: этилметансульфонат (ЭМС) 0.3; 0.2; 0.04; 0.03; 0.02; диметилсульфат (ДМС) 0.08; 0.04; 0.02; диэтилсульфат (ДЭС) 0.05; 0.025%. Контрольный вариант - замачивание в воде. Экспозиция составляла 16 часов. В каждом варианте было обработано по 300 семян петунии. Семена поколения М2 и М3 собирали отдельно с каждого растения. Идентификация антоцианидинов. В период массового цветения лепестки растений фиксировали в стандартной смеси 97% этанола и концентрированной соляной кислоты (99:1). В надосадочной жидкости анализировали состав и содержание антоцианов. Была использована UPLС/MS система, состоящая из хроматографа Waters Acquity и тандемного квадрупольного МС-детектора TQD (Waters). Анализировали 2 мкл экстракта на колонке 0.21x5cm Column Acquity BEH C18 (1.7um) при 350С и скорости потока 0.5 мл/мин с использованием элюентов А: 20 мМ раствор муравьиной кислоты в воде и В: 20 мМ раствор муравьиной кислоты в ацетонитриле по градиентной программе 5-5%В (0.2 мин) 5-100%В (0.8 мин), 100-100%В (0.5 мин), 100-5%В (0.1 мин), 5-5%В (1.5 мин) с диодно-матричной УФ-детекцией (от 220 до 500 нм) и МС-детекцией (от 250 до 700 m/z). Параметры МС-детектора: Capillary Voltage 3kV, Cone Voltage 55 V, Extractor Voltage 5 V, RF Lens 0.2V, Source Temperature 120C, Desolvation Temperature 450 C, Desolvation Gas Flow 800 L/hr, Cone Gas Flow 50 L/hr, LM Resolution 1 - 14.0, HM Resolution 1 - 14.5, Ion Energy 1 - 0.4. В качестве стандартов-метчиков для идентификации антоцианов использовали экстракт из ягод черники. Таблица 1
Наличие (+) или отсутствие (-) антоцианидина Идентификацию флавонолов осуществляли по специфической ярко-голубой или синей флуоресценции в УФ-свете (длины волн 254 и 366 нм) после разделения этанольных экстрактов методом тонкослойной хроматографии на целлюлозе в системе н-бутанол:уксусная кислота:вода в соотношении 4:1:5 (верхняя фаза) [7]. Также использовали качественные реакции: смесь 1%-ных водных растворов FeCl3 и K3[Fe(CN)6] (на все классы фенольных соединений) и 1%-ный раствор AlCl3 в этаноле (на флавонолы) [8]. РЕЗУЛЬТАТЫ Окраска цветка. Влияние всех трех мутагенов проявилось уже в поколении М1, что проявлялось в значительных изменениях окраски цветков у большинства вариантов. После воздействия ДЭС формировались растения с бутонами окрашенными в розоватый или сиреневатый цвет, а открытые цветки были белыми (8%). В случае действия ДМС (0.8%) наибольшее число растений имело светло-сиреневые, сиренево-розовые или розовые венчики (17 %). Растения с наиболее интенсивной окраской цветка (фиолетовой) были отмечены только при использовании 0.04% ДМС. Кроме изменений основной окраски были получены формы с «сеткой» в зеве, зеленоватыми жилками, зеленоватым или лимонно-желтым горлом, центром венчика у растений сорта 'Snow Ball'. При использовании 0.02% ЭМС было обнаружено 11% растений с сиреневыми цветками с белым или бледно-желтым центром и желто-зеленым зевом, сиреневые цветки с темно-сиреневым кольцом вокруг зева, темно-сиреневыми с белым или зеленоватым зевом. Таблица 2
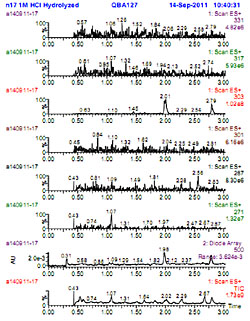
В потомстве растений М2 с бледно-окрашенными цветками появились растения с цветками практически всех возможных оттенков. Наиболее контрастные изменения происходили после обработки семян 0.08% ДМС. В этом случае цветки имели окраску от фиолетовой и синевато-сиреневой до розовой. Кроме того, для всех растений семьи 46-4 характерно пятно в центре, причем как окрашенного, так и белого венчика. Состав флавоноидов. Изучение состава флавоноидов показало отсутствие в цветках петунии дикого типа антоцианов (табл.1, рис. 1) и присутствие флавонолов - кемпферола, кверцетина и мирицетина (табл.2). У мутантных растений в окрашенных цветков обнаружили, главным образом, мальвидин и петунидин, тогда как дельфинидин, цианидин и пеонидин встречались редко. В неокрашенной средней части цветков этих растений накапливались мирицетин, кверцетин и редко – кемпферол, как это отмечалось и у дикого типа. Контрастные различия в окраске отдельных участков венчика цветка (розовая – фиолетовая с синим) могут быть обусловлены независимыми мутациями, приводящими к изменениям в экспрессии генов. Предположение, что различные окраски в разных частях цветка связаны с различными концентрациями одного пигмента не верно, по данным анализа в разных частях цветков содержатся различные антоцианидины. Так, в синих с розовым центром цветках растения 33-9-7 обнаружены дельфинидин и петунидин. Эти результаты показывают, что в результате мутации синтез антоцианов в различных частях цветка может происходить независимо (несогласованно). Таким образом, данные биохимического анализа показывают, что появление новых окрасок цветка у петунии было вызвано обратными мутациями, восстановившими нормальный синтез антоцианов [6] в цветках петунии, а различия в экспрессии генов биосинтеза в разных частях цветка [9], привело к появлению антоцианидинов в результате действия мутагенов ДМС и ЭМС. ЛИТЕРАТУРА
| Внимание! Эта статья опубликована, на нее можно ссылаться при написании научных работ. Ссылка на эту публикацию выглядит так: Широкова А.В., Николаева Т.Н., Ташлицкий В.Н., Костяновский Р.Г., Кадоркина Г.К., Крутиус О.Н. Влияние химических мутагенов на изменчивость окраски и образование антоцианов и флавонолов в цветках Petunia hybrida HORT. // Фенольные соединения: фундаментальные и прикладные аспекты: материалы докладов VIII Международного симпозиума. Москва, 2-5 октября 2012 г. /отв. ред. Н.В. Загоскина – М.: ИФР РАН; РУДН, 2012. С. 492-498. (ISBN 978-5-209-04571-7). Иллюстрации к этой статье: Рис. 1. ВЭЖХ/масспектрометрия антоцианидинов экстрактов венчиков Petunia hybrida дикого типа (сорт 'Snow Ball') | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
(с) Авторские права: перепечатка и копирование материалов разрешена без ограничений с простановкой ссылок на авторов и издание, где опубликован материал.
Copyrights: Non commercial using of these materials is permitted with obligatory informing of the authors and linking to the source.