|
УЧАСТИЕ ТЯЖЕЛЫХ МЕТАЛЛОВ В РЕГУЛЯЦИИ ОБРАЗОВАНИЯ ФЕНОЛЬНЫХ СОЕДИНЕНИЙ В КЛЕТКАХ ВЫСШИХ РАСТЕНИЙ Загоскина Н. В., Лапшин П.В., Гончарук Е.А., Николаева Т.Н., Нечаева Т.Л., Алявина А.К.Москва, Институт физиологии растений им. К.А. Тимирязева РАН, Ботаническая, 35, ofr@ippras.ru В последнее время все большее внимание исследователей привлекают вопросы изучения действия различных стрессовых факторов, в том числе и тяжелых металлов, на жизнедеятельность растений [1, 2]. Одним из наиболее распространенных в природе поллютантов является кадмий, для которого характерна высокая подвижность в почвенном растворе и быстрое поступление в растения. При этом снижается транспорт метаболитов в листья и стебли, наблюдается их хлороз и угнетение роста [3-5]. При действии кадмия возникает широкий спектр мутаций, включая точечные и хромосомные аберрации, а также меняется морфология ядра [6, 7]. Кроме того, он способствует возникновению окислительного стресса в растительных клетках, что приводит к изменению активности ряда ферментов, в том числе супероксиддисмутазы, каталазы, оксидазы и др.[4, 8, 9]. Сообщалось также о замене металлов, входящих в металлобелковые комплексы растительных клеток, на кадмий, что влияло на некоторые биохимические процессы [5, 10-12]. В тоже время в растениях существуют и защитные системы, способствующие ослаблению токсического действия этого тяжелого металла на клеточные процессы. В частности, за счет выделений из корневых волосков, а также накопления в клеточных стенках и вакуолях [2, 13]. Следовательно, толерантность растений к действию кадмия явление сложное, зависящее как от внешних факторов, так и от вида и возраста растения [2, 7, 13, 14]. Несмотря на многочисленные исследования, посвященные изучению влияния кадмия на растительные организмы, до сих пор многие аспекты его действия не ясны. Это относится и к фенольным соединениям, являющимся одними из наиболее распространенных в растениях представителей вторичного метаболизма. Известно, что они способны взаимодействовать с металлами [15]. Кроме того, фенольные соединения проявляют антиоксидантые свойства, связывая активные формы кислорода и другие свободные радикалы, возникающие при действии многих стрессовых факторов [15, 16]. Все это свидетельствует о том, что эти вещества так называемого «вторичного происхождения» выполняют важные функции в клетках растений, в том числе способствуя сохранению их жизнеспособности в стрессовых условиях [17], к числу которых можно отнести и действие тяжелых металлов. Удобным подходом для изучения клеточного метаболизма являются культуры in vitrо. Их преимуществом по сравнению с растениями является более простой уровень внутритканевой и внутриклеточной организации, а также рост в четко контролируемых условиях [18]. При этом, в большинстве случаев клеточные культуры сохраняют способность к синтезу характерных для интактных тканей вторичных метаболитов, в том числе и фенольной природы [19, 20]. Это позволяет успешно использовать их для изучения фенольного метаболизма и его роли в жизни растений, в том числе и при адаптации к стрессовым условиям [7, 21]. Одним из удобных объектов для таких исследований являются каллусные культуры чайного растения, обладающие специализированным обменом, направленным на синтез различных соединений фенольной природы (фенилпропаноидов, флавоноидов, лигнина) [22]. Целью нашей работы являлось сравнение ответа каллусных культур, инициированных из листа, стебля и корня чайного растения, на действие различных концентраций кадмия на уровне накопления фенольных соединений. Такой подход интересен тем, что клетки, выращиваемые в условиях in vitro, часто сохраняют эпигенетические характеристики, свойственные исходным эксплантам [18]. В связи с этим сопоставление изменений в накоплении фенольных соединений у этих культур, в определенной степени позволит понять реакцию клеток различных органов чайного растения на действие кадмия. Одновременно с анализом содержания фенольных соединений анализировали рост культур и изучали локализацию в них полифенолов. Экспериментальная часть В работе использовали каллусные культуры, инициированные из листьев, стеблей и корней проростков чайного растения (Camellia sinensis L., грузинская разновидность). Культуры выращивали в темноте на модифицированной питательной среде Хеллера, содержащей 2,4-дихлорфеноксиуксусную кислоту (5 мг/л) и глюкозу (25 г/л) [23]. В опытных вариантах к питательной среде добавляли 6.3 х 10-5 М или 10.6 х 10-5 М кадмия (в виде нитрата кадмия), в условиях действия которых, как показали наши предварительные данные, рост каллусов сохранялся, чего не наблюдалось при более высоких концентрациях металла (культуры погибали). О характере роста культур судили по изменению прироста свежей массы каллусов за период культивирования (45 дней; 8-кратная повторность). Размер исходных трансплантантов составлял 150-170 мг свежей массы. Содержание воды в ткани определяли после ее высушивания до постоянного веса при 700 (3-кратная повторность). Для извлечения фенольных соединений каллусы подвергали экстракции горячим 96%-ным этанолом. В этанольных экстрактах спектрофотометрическим методом определяли содержание суммы растворимых фенольных соединений с реактивом Фолина-Дениса (поглощение при 725 нм) и содержание флаванов - с 1%-ным раствором ванилина в 70%-ной серной кислоте (поглощение при 500 нм) [24]. Калибровочные кривые в обоих случаях строили по (-)-эпикатехину. Для определения лигнина каллусные ткани подвергали последовательной экстракции этанолом, смесью этанол+бензол (1:2) и горячей водой (95(С, 2 ч) и в завершении промывали 96%-ным этанолом и эфиром. Полученный таким образом свободный от экстрактивных веществ остаток гидролизовали 0,5н NaOH в течение 36 ч при 80(С. Охлажденный гидролизат центрифугировали (1000 g, 10 мин) и в надосадочной жидкости спектрофотометрически (при 610 нм) определяли содержание лигнина по реакции с 2,6-дихлорхинонхлоримидом (25(. Калибровочную кривую строили по феруловой кислоте. Для цитохимических исследований использовали срезы свежезамороженных каллусных тканей толщиной 30 мкм, полученные с помощью микротома-криостата (Россия). Локализацию флаванов определяли по реакции с ванилиновым реактивом, а локализацию лигнина – по реакции с флороглюцином [22]. Препараты просматривали и фотографировали с помощью светового микроскопа Ergavall (Германия). На рисунках представлены средние арифметические значения из 3-х определений и их стандартные отклонения. Для каждого определения использовали 3 каллуса в 3-х аналитических повторностях. При определении прироста каллусной массы использовали 10 каллусов. Результаты Каллусные культуры чайного растения листового, стеблевого и корневого происхождения, выращиваемые на основной питательной среде, представляли собой медленно растущие плотные каллусы желтого цвета. У стеблевой культуры прирост свежей массы к концу пассажа был значительно выше, чем у корневой и, особенно, листовой культур (рис. 1). Определение содержания фенольных соединений выявило значительные различия в биосинтетической способности каллусных культур чайного растения (рис. 2). Наибольшее накопление суммы растворимых фенольных соединений отмечено у листового каллуса, а наименьшее – для корневого (различия между ними превышали 500%). У стеблевого же каллуса содержание фенольных соединений было в 3 раза ниже, чем у листового и в 1.5 раза выше, чем у корневого каллуса. Аналогичная тенденция характерна и для накопления флаванов – соединений, являющихся основными компонентами фенольного комплекса как чайного растения, так и инициированных из него каллусных культур [23, 26]. Наибольшее их количество обнаружено в листовом каллусе, в стеблевом каллусе оно было в 3 раза ниже, а в корневом составляло лишь 6 % и 20 % от такового листового и стеблевого каллусов, соответственно (рис. 3). При этом, у корневого каллуса, характеризующегося самой низкой биосинтетической способностью, на долю флаванов приходилось лишь 30% от суммарного содержания фенольных соединений, тогда как в остальных культурах - около 90% (см. рис. 2 и 3). Исходя из этого, можно предположить, что в каллусных клетках, инициированных из надземных органов (лист и стебель), синтез фенольных соединений направлен преимущественно на образование флаванов, тогда как у каллуса корневого происхождения – на образование нефлавановых веществ, вероятно фенилпропаноидов, как это характерно для интактных тканей чайного растения [26]. Помимо растворимых фенольных соединений, каллусные культуры чая синтезируют фенольный полимер лигнин. Культуры корневого и листового происхождения обладали более высокой и почти одинаковой способностью к его накоплению, а у стеблевого каллуса содержание лигнина было на 30% ниже (рис.4). Выращивание культур на средах с кадмием приводило к некоторым изменениям в их морфологии. Каллусы становились чуть менее плотными и приобретали коричневатый цвет. На поверхности некоторых из них изредка отмечалось формирование небольших участков темно-коричневого цвета. В большей степени эти изменения проявлялись на среде с 10.6 х 10-5 М кадмия. Внесение кадмия в среду культивирования не влияло на рост корневого каллуса (рис. 1). Прирост же стеблевого и листового каллуса снижался на среде с 6.3 х 10-5 М кадмия, соответственно, на 50% и 35% по сравнению с контролем , а при 10.6 х 10-5 М – на 64% и 40%. Определение содержания воды в каллусах листового, стеблевого и корневого происхождения, растущих на средах с кадмием, показало что в опытных вариантах оводненность клеток была ниже, чем в контроле (соответственно, 85,3%, 83,4% и 82,1% против 89,1%, 85,2% и 84,8% ) и не зависела от концентрации кадмия в среде. Присутствие кадмия в среде влияло на способность каллусных культур к образованию фенольных соединений. При концентрации металла 6.3 х 10-5 М содержание суммы растворимых фенольных соединений в корневом и стеблевом каллусах увеличивалось (на 50% и 87% по сравнению с контролем, соответственно), тогда как в листовом каллусе незначительно снижалось (рис. 2). При более высокой концентрации кадмия (10.6 х 10-5 М) эта тенденция сохранялась, хотя и была менее выражена. В этом случае суммарное накопление фенольных соединений у корневого и стеблевого каллуса превышало таковое контрольного варианта лишь на 13% и 6%, соответственно, а у листового каллуса содержания фенольных соединений снижалось еще в больше (на 20% по сравнению с контролем). Что касается флаванов, то как и в случае растворимых фенольных соединений, в каллусах корневого и стеблевого происхождения при действии кадмия их уровень превышал таковой контрольных вариантов (рис. 3). У стеблевого каллуса эти изменения проявлялись в большей степени при низкой концентрации металла (в 1.8 раза), а у корневого каллуса – при высокой (в 1.6 раза). В случае листового каллуса накопление флаванов в присутствии кадмия было ниже, чем в контроле, особенно при концентрации 10.6 х 10-5 М (почти в 2 раза). Определение содержания лигнина показало, что в листовом каллусе оно не менялось, тогда как в корневом и, особенно, стеблевом каллусах увеличивалось (рис. 4). В большей степени это проявлялось при концентрации кадмия 6.3 х 10-5 М. Важным аспектом в жизнедеятельности растительных клеток является не только интенсивность синтеза вторичных соединений, но и их локализация. Цитологические исследования показали, что каллусные культуры, инициированные из различных органов чайного растения, были представлены клетками паренхимного типа. Иногда среди них встречались трахеидальные элементы (рис. 5). Проведение реакции с ванилиновым реактивом, позволяющим выявить локализацию флаванов, основных компонентов фенольного комплекса каллусных культур чая, показало их присутствие в содержимом клеток, а также в межклеточном пространстве (рис. 6 ). В листовом каллусе число клеток, дающих реакцию с ванилиновым реактивом было больше, чем в стеблевом и корневом каллусах. Следует отметить, что у культур, растущих на средах с кадмием, наблюдалось утолщение клеточных стенок (рис. 5 Б). Усиливалась и реакция на флаваны, которая обнаруживалась не только в содержимом клеток и межклетниках, как в контрольном варианте, но и в клеточных стенках (рис. 6). В последнем случае это, вероятно, является следствием отложения в них проантоцианидинов, являющихся производными флавановой природы с более высокой молекулярной массой [15]. О том, что эти соединения фенольной природы могут являться компонентами клеточных стенок растений уже упоминалось в литературе [27]. Изучение локализации лигнина (реакция с флороглюцином) показало его присутствие в клеточных стенках каллусных культур, межклетниках, а иногда и в содержимом клеток (рис. 7). При действии кадмия наблюдали усиление лигнификации клеток, особенно в нижней, примыкающей к питальной среде, части каллусов. Обсуждение Известно, что кадмий оказывает значительное стрессовое воздействие на растения [2]. При этом происходит не только угнетение их роста, но и изменяются многие метаболические процессы [1, 4, 7-9]. Поскольку, судя по последним литературным данным, фенольные соединения являются компонентами защитной системы растений от стрессовых воздействий [15, 28], то представлялось важным выявить ответные реакции клеток на присутствие кадмия в среде, используя для этого каллусные культуры чайного растения, характеризующиеся высокой способностью к синтезу фенольных соединений [21, 23]. Важным показателем реакции клеток на действие любого стрессового фактора является их ростовая активность. В нашем случае, у большинства каллусных культур чайного растения, за исключением культуры корневого происхождения, отмечалось снижение прироста биомассы (см. рис. 1). В большей степени эти изменений проявлялись при более высокой концентрации металла (10.6 х 10-5 М) в среде. Следовательно, каллус корневого происхождения был устойчив к действию кадмия, в отличии от каллусов листового и, особенно, стеблевого происхождения, для которых характерно значительное снижение роста. Известно, что кадмий инициирует окислительный стресс в растительных клетках и, как следствие, образование свободных радикалов [8]. Фенольные же соединения в этом случае могут выполнять роль эндогенных антиоксидантов, многие из которых по своей активности не уступают таким соединениям как аскорбиновая кислота [28]. Именно этим, вероятно, и объясняется накопление фенольных соединений в каллусных культурах чайного растения, растущих на средах с кадмием (см. рис. 2 и 3). Исключением являлся лишь листовой каллус, у которого при действии тяжелого металла их уровень снижался. Вероятно для этой культуры, характеризующейся наиболее высокой способностью к синтезу фенольных соединений, эндогенного их содержания достаточно для выполняемых ими функций, в том числе и антиоксидантных, а уменьшение количества этих веществ под влиянием кадмия является следствием ослабления клеточного метаболизма на фоне снижения роста культуры (см. рис.1). При действии кадмия в большинстве случаев в каллусных культурах увеличивалось содержание полимера фенольной природы лигнина (особенно при концентрации 6.3 х 10-5 М). Исключением являлся лишь листовой каллус, у которого изменений в накоплении лигнина не наблюдалось. Лигнин является одним из важнейших компонентов вторичных клеточных стенок растений [15] и его накопление косвенно свидетельствует о морфологических изменениях в каллусных культурах. Это согласуется и с полученными нами данными об утолщении клеточных стенок каллусов при действии кадмия (см. рис. 7). Возможно, эти изменения в структуре клеток являются одной из их приспособительных реакций к данному воздействию. О защитной функции лигнина при действии разнообразных стрессовых факторов неоднократно сообщалось в литературе [15, 17]. Поскольку кадмий связывается с карбоксильными и гидроксильными радикалами различных соединений[13], к которым можно отнести и лигнин [15], то полученные нами данные свидетельствует о том, что лигнин выполняет «барьерную» функцию, препятствуя поступлению кадмия в цитоплазму растительных клеток и тем самым снижает его токсическое действие на клеточный метаболизм. Таким образом, при действии кадмия у каллусных культур чайного растения активируется синтез как мономерных, так и полимерных форм фенольных соединений, интенсивность которого зависит как от концетрации металла в среде, так и от органоспецифичности клеток. Следует также подчеркнуть, что различная реакция каллусов чайного растения листового, стеблевого и корневого происхождения на действие кадмия может быть следствием сохранения в условиях in vitro как эпигенетических, так и генетических характеристик тканей интактного растения [18]. В связи с этим, механизмы, обеспечивающие устойчивость клеток при воздействии стрессового фактора в условиях in vivo, в значительной степени определяют ответные реакции дедифференцированных растительных клеток в условиях in vitro. Работа выполнена при поддержке Российского фонда фундаментальных исследований (грант 04-04-49408, 07-04-00909). ЛИТЕРАТУРА
| Внимание! Эта статья опубликована, на нее можно ссылаться при написании научных работ. Ссылка на эту публикацию выглядит так: Гончарук Е.А., Алявина А.К., Лапшин П.В., Николаева Т.Н., Нечаева Т.Л., Загоскина Н.В. Участие тяжелых металлов в регуляции образования фенольных соединений в клетках растений. В сб. Фенольные соединения: фундаментальные и прикладные аспекты (под редакцией Н.В. Загоскиной, Е.Б. Бурлаковой). М.: Научный мир. 2010, С. 300-308. Иллюстрации к этой статье:
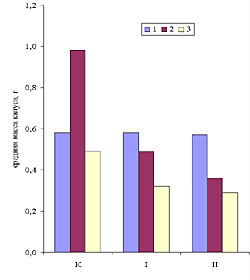
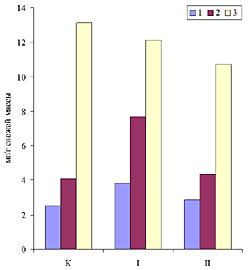
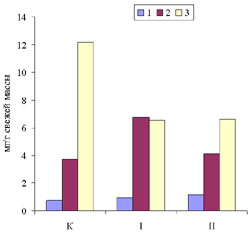
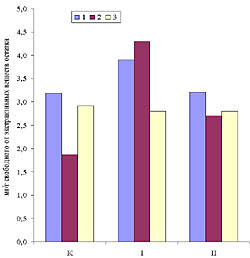
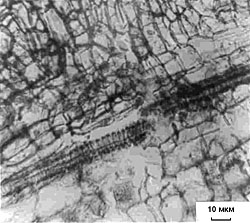
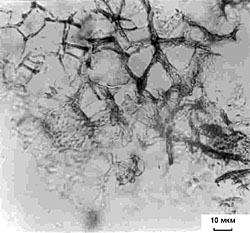
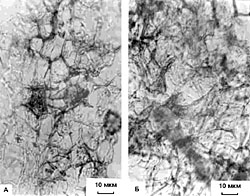
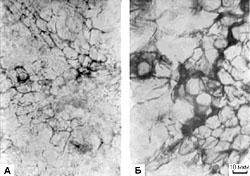
Рис. 1. Прирост свежей массы каллусов корневого (1), стеблевого (2) и листового (3) происхождения, растущих на основной питательной среде (К) или на средах, содержащих кадмий в концентрации 6.3 х 10-5 М (I) или 10.6 х 10-5 М (II). Возраст культуры 45 дней. Рис. 2. Содержание суммы растворимых фенольных соединений в каллусных культурах корня (1), стебля (2) и листа (3) чайного растения, выращиваемых на основной питательной среде (К) или на средах, содержащих кадмий в концентрации 6.3 х 10-5 М (I) или 10.6 х 10-5 М (II). Рис.3. Содержание флаванов в каллусных культурах корня (1), стебля (2) и листа (3) чайного растения, выращиваемых на основной питательной среде (К) или на средах, содержащих кадмий в концентрации 6.3 х 10-5 М (I) или 10.6 х 10-5 М (II). Рис.4. Содержание лигнина в каллусных культурах корня (1), стебля (2) и листа (3) чайного растения, выращиваемых на основной питательной среде (К) или на средах, содержащих кадмий в концентрации 6.3 х 10-5 М (I) или 10.6 х 10-5 М (II). Рис. 5. Каллусные культуры стебля чайного растения, выращенные на основной питательной среде (А) или на среде с 6.3 х 10-5 М кадмия (Б) . Рис. 6. Каллусные культуры стебля чайного растения, выращенные на основной питательной среде (А) или на среде с 6.3 х 10-5 М кадмия (Б) (окрашивание ванилином). Рис. 7. Каллусные культуры стебля чайного растения, выращенные на основной питательной среде (А) или на среде с 6.3 х 10-5 М кадмия (Б) (окрашивание флороглюцином). |
(с) Авторские права: перепечатка и копирование материалов разрешена без ограничений с простановкой ссылок на авторов и издание, где опубликован материал.
Copyrights: Non commercial using of these materials is permitted with obligatory informing of the authors and linking to the source.